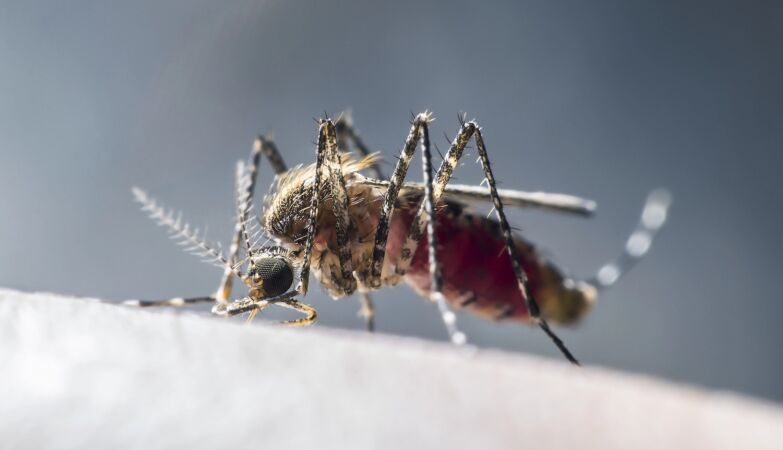
As numerosas e variadas de técnicas de controlo das populações de mosquitos desenvolvidas nos últimos anos permitir-nos-iam erradicar as espécies mais perigosas destes insetos. Mas, moralmente e do ponto de vista da biodiversidade, será correto fazê-lo?
Felicola (Lorisicola) isidoroi é uma criatura provavelmente extinta ou em vias de o estar — o que, para os biólogos, representa uma perda de biodiversidade. Para todos os outros, é apenas mais um inseto — um parasita que vive da sucção de sangue.
A sua caraterística invulgar é o facto de o seu único hospedeiro ser o lince ibérico. No passado, deve ter estado presente em grande parte da Península Ibérica, mas a última vez que os cientistas o encontraram foi em 1997.
Tal como o felino, que já foi o mais ameaçado do planeta, o inseto também partilhou esse mesmo caminho para a extinção até que os humanos decidiram salvar o felino, mas não o seu parasita.
O programa de recuperação do lince inclui a desparasitação dos exemplares libertados na natureza, procedimento que também é realizado em caso de captura.
Jesús María Pérez, zoólogo e especialista em pragas e parasitas da Universidade de Jaén, no sul de Espanha, considera que o piolho continua a ser uma espécie muito mais rara do que o próprio lince, e que também deve ser salvo porque faz parte da biodiversidade.
“Como produto único da evolução, tem um valor incalculável”, diz Pérez.
O dilema colocado pelo piolho do lince é o mesmo levantado por muitos outros parasitas, pragas e espécies que, como alguns mosquitos, não são patogénicas, mas transportam as doenças.
Recentemente, um grupo de biólogos, ecologistas e sociólogos publicou na revista Science um artigo de opinião cujo título deixa claro o seu tema: “Extinção deliberada por modificação do genoma: Um desafio ético”.
Os seres humanos são bons a extinguir a vida. Nos últimos cinco séculos, desapareceram 73 ramos inteiros da árvore evolutiva.
Mas já não somos tão bons quando se trata de eliminar agentes patogénicos. Apesar de todos os progressos da medicina a que assistimos no final do século XIX e meados do século XX (higiene, vacinas, antibióticos, etc.), o número de doenças infecciosas erradicadas pode ser contado pelos dedos nas nossas mãos.
Mesmo nestes casos, como por exemplo caso de oncocercose (ou “cegueira dos rios”), infecção filarioide que provoca lesões na pele e pode levar a deficiência visual, o que está a ser erradicado é a doença e não o agente causador. Nesse sentido, o caso do piolho do lince é verdadeiramente excecional.
Ao longo da história recente da nossa guerra contra os insetos nocivos para o ser humano, foram utilizados todos os tipos de técnicas, incluindo armadilhas, a introdução de outras espécies, inseticidas de nova geração, pesticidas, irradiação de populações de mosquitos para as esterilizar — e até torná-los surdos.
Atualmente, estamos também a pensar na modificação genética. Tirando partido da existência de certos condutores genéticos que não seguem as leis de Mendel, é possível selecionar certas caraterísticas, dando ao gene modificado mais de 50% de hipóteses de ser transmitido à geração seguinte.
Com a tecnologia de edição genética CRISPR, a mutação desejada pode ser transmitida a todos os descendentes e permanecer presente em gerações sucessivas.
Nunca antes tinha sido possível interferir no destino de uma espécie de uma forma tão radical. “Tem de haver uma justificação moral muito forte, e essa justificação exigirá mais do que o interesse económico próprio”, afirma Gregory Kaebnick, investigador do Centro Hastings para a Bioética, em Garrison, Nova Iorque, e co-autor do artigo.
“As espécies mais susceptíveis de serem erradicadas são as que causam grande sofrimento. A decisão exige a colaboração das sociedades afetadas pela doença em questão, e nós defendemos que se trata de um problema local e global” explica Kaebnick.
A bicheira-do-novo-mundo, o “parasita que come pessoas”, é uma das candidatas a ser eliminada da face da Terra. É a fase larvar da mosca Cochliomyia hominivorax. As moscas põem os seus ovos em feridas, mucosas danificadas de uma grande variedade de mamíferos, incluindo os humanos.
“Uma fêmea pode pôr cerca de 500 ovos”, explica Pablo Martínez Labat, diretor do departamento de parasitologia da Escola de Estudos Superiores de Cuautitlán, da Universidade Autónoma do México (UNAM).
Em duas semanas, os ovos eclodem e as larvas alimentam-se dos tecidos do hospedeiro: “tecidos vivos, mas contaminados com agentes bacterianos”, explica Martínez Labat. Se nada for feito para tratar a doença, a pessoa infetada pode morrer.
Este parasita estava presente em todas as regiões quentes das Américas, com uma incidência elevada nas regiões de criação de gado. Mas o início da era atómica marcou o princípio do fim deste parasita.
Após anos de pesquisas, em 1959, investigadores americanos libertaram milhares de machos adultos na ilha caribenha de Curaçau. As moscas tinham sido irradiadas para as esterilizar na sua fase de pupa.
A um ritmo de 200 mil por semana e 300 indivíduos libertados por quilómetro quadrado, eliminaram a C. hominivorax em poucas semanas. O sucesso foi tal que os agricultores da Flórida pressionaram por um programa em grande escala.
Libertaram 50 milhões de moscas irradiados ao longo de várias semanas, eliminando 90% da população selvagem em três meses. Os restantes estados americanos de criação de gado seguiram o exemplo, o que levou à erradicação da mosca do próprio território na década de 1970.
O mesmo foi feito no norte do México para criar uma zona-tampão. Nessa altura, a bicheira-do-novo-mundo desapareceu do território mexicano e de alguns países da América Central.
“A fábrica que instalaram no México tinha capacidade para criar 500 milhões de larvas por semana”, recorda o parasitologista da UNAM. Mas em 2018, ela foi desmontada e transferida para o Panamá.
No início, não parecia uma má ideia; uma vez erradicada da América do Norte, era preciso detê-la no flanco sul. Mas por várias razões, os casos no norte estão agora a começar a reaparecer.
O afluxo de pessoas de países como a Colômbia e a Venezuela, onde o parasita é abundante, poderá estar na origem desta situação. Há novos planos para combinar a irradiação com a modificação genética, o que poderia significar o seu fim definitivo.
Entretanto, os planos contra os mosquitos transmissores de doenças não visam a sua extinção total, mas sim a eliminação local, quando necessário.
Segundo o El País, a combinação de radiações com mecanismos de propagação genética forçada reduziu a incidência da dengue em várias zonas das Américas graças aos mosquitos criados pela empresa Oxitec.
No entanto, a letalidade da dengue não está nem perto do número de mortes provocadas pela malária, que mata meio milhão de pessoas por ano. Por esta razão, o artigo da Science aponta o Anopheles gambiae, o seu principal vetor, como um alvo eticamente aceitável.
“Nos últimos anos, temos tido grande sucesso em laboratório na criação de mosquitos modificados por propagação genética (GDMM) que poderão um dia ser usados como ferramentas para controlar a malária em África”, diz John Connolly, investigador do Imperial College de Londres e cientista-chefe do Target Malaria, um projeto financiado pela Fundação Bill Gates.
Atualmente, estão a ser consideradas duas estratégias de GDMM. Uma delas procura reduzir a população de mosquitos, afetando a fertilidade das fêmeas, ao libertar machos estéreis.
Outra abordagem procura introduzir caraterísticas genéticas na população que reduzam a viabilidade do agente patogénico que transportam. É importante lembrar que o agente causador da malária é um parasita protozoário do género Plasmodium.
“Isso só aconteceria quando os dados laboratoriais, a modelação matemática e uma avaliação rigorosa dos riscos indicassem que as unidades genéticas para o controlo da malária tinham um perfil de segurança que permitiria a aprovação regulamentar e a adesão das partes interessadas em África”, esclareceu Connolly.
“As espécies são valiosas por si mesmas, mesmo para além da sua contribuição para o ecossistema. No entanto, por vezes, a ponderação do sofrimento que nos causam ou aos animais ao nosso cuidado pode justificar a sua erradicação“, conclui Kaebnick.