Jean-Francois Monier / AFP
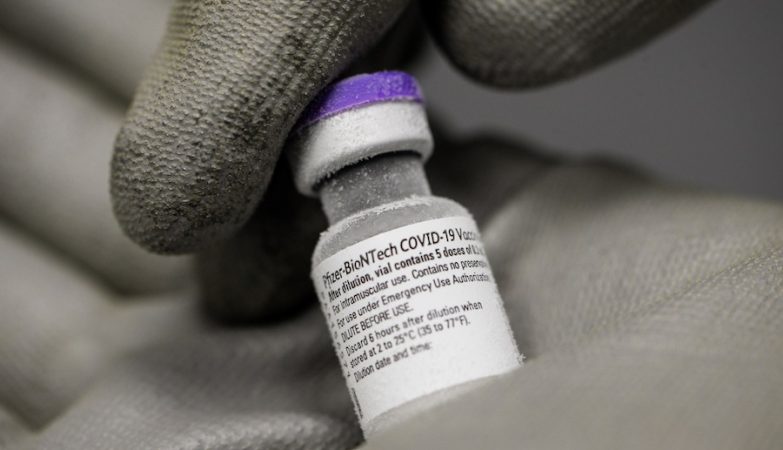
A Pfizer solicitou autorização à reguladora do medicamento nos EUA (FDA, na sigla em inglês) para a aplicação de uma dose de reforço da sua vacina contra o novo coronavírus, que contempla atualmente duas injeções.
A farmacêutica informou na quarta-feira que começou o processo de pedido de autorização para uma terceira dose da sua vacina para pessoas com 16 ou mais anos, devendo estar terminado até ao final da semana.
No início do mês, a FDA disse que as pessoas que tenham recebido transplantes ou outras com sistemas imunitários enfraquecidos podem receber uma dose extra da vacina da Pfizer ou da Moderna. Depois, na última semana, dirigentes do setor da saúde dos EUA anunciaram planos para dar vacinas de reforço para aumentar a proteção dos norte-americanos perante o crescendo da variante delta.
Esta intenção suscitou críticas de cientistas da Organização Mundial de Saúde, que salientaram que os países pobres ainda nem têm vacinas suficientes para a sua primeira ronda de vacinação.
A vacina da Pfizer, desenvolvida em conjunto com a alemã BioNTech, recebeu a aprovação total no início desta semana, também para pessoas com 16 anos ou mais. Estava a ser aplicada a este grupo etário sob uma autorização para uso de emergência, o que continua a ser o caso para o grupo 12-15 anos.
Mais de 200 milhões de doses da vacina da Pfizer já foram administradas nos EUA – e outras centenas de milhões à escala mundial – desde que obteve a autorização em dezembro.
As três vacinas usadas nos EUA, produzidas por Pfizer, Moderna e Johnson & Johnson, continuam a ser eficazes na prevenção de hospitalizações e mortes pelo novo coronavirus. Mas as vacinas não parecem tão fortes contra a altamente contagiosa variante delta como têm sido contra as versões iniciais.
O plano nos EUA é aplicar uma dose extra oito meses depois de as pessoas terem tido a segunda dose das vacinas da Pfizer ou da Moderna.
Também na quarta-feira, a J&J disse que as pessoas que receberam uma vacina de reforço à sua, de toma única, tiveram um aumento acentuado dos anticorpos de combate ao vírus. Esta farmacêutica pretende falar com a FDA sobre este reforço vacinal.
A Moderna também deve fazer o mesmo. Na quarta-feira informou que tinha completado o processo na FDA a solicitar a aprovação plena da sua vacina de duas tomas.
// Lusa