ZAP // Venigalla B. Rao; Victor Padilla-Sanchez, Andrei Fokine, Jingen Zhu
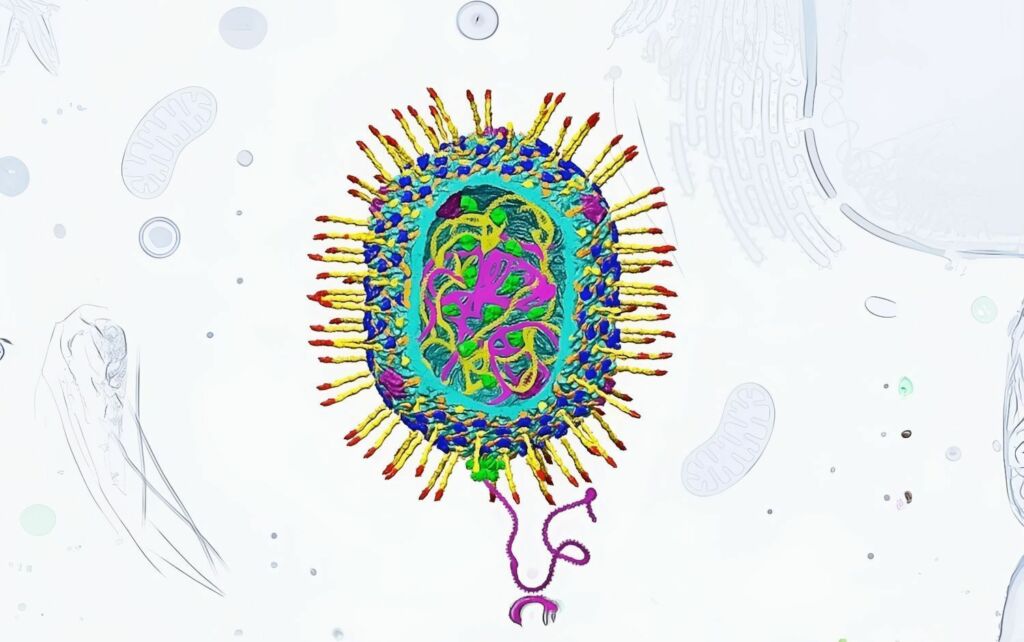
Modelo do bacteriófago T4 em que foi baseado o vírus avançado desenvolvido pelos investigadores
Vírus modificado em laboratório é capaz de transportar cerca de 20 vezes mais DNA do que os vírus utilizados em terapia genética. Este avanço científico permitirá fazer mudanças complexas no interior das células.
Nem todos os vírus são capazes de infetar seres humanos. Há um tipo de vírus, designado por bacteriófagos, ou simplesmente fagos, capazes de atacar e matar bactérias, sem nenhum impacto no corpo humano.
Os fagos têm vindo a ser alvo de estudos, uma vez que podem ser utilizados para transportar material para as células humanas, de uma forma muito mais rápida e eficiente do que outras técnicas existentes.
Recentemente, foi desenvolvido um fago capaz de transportar 20 vezes mais DNA do que os fagos anteriores. Esta capacidade de transporte pode levar a grandes avanços no campo da terapia genética e celular, permitindo fazer mudanças complexas nas células de uma só vez.
Este novo vírus modificado pode transportar cadeias de DNA com uma extensão até 171 000 pares de base.
Além de DNA, este vírus pode carregar mais de 1 000 outras moléculas como RNA e proteínas, explica Venigalla Rao, investigador da Universidade Católica da América, em Washington DC, e autor principal do artigo que apresenta o vírus, publicado em maio na revista Nature Communications.
“Podemos combinar tudo isto numa única partícula e tentar não apenas a terapia, mas potencialmente a cura”, afirma Rao.
Há já um grande número de tratamentos que envolve a modificação de células dentro e fora do corpo. No entanto, o maior desafio destas terapias está na forma como se entrega ou transporta os componentes necessários até às células.
Um exemplo simples está na síndrome de Duchenne, um tipo de distrofia muscular que causa fraqueza muscular progressiva. Esta doença acontece devido a várias mutações no gene responsável por produzir a distrofina, uma proteína essencial para os músculos.
No passado tentou-se por diversas vezes introduzir o gene saudável, sem mutações, nas células de pacientes afetados, mas sem sucesso. O grande obstáculo estava no tamanho do gene da distrofina, que tem 11 000 pares de base.
Nesta investigação, a equipa de Rao foi capaz de entregar o gene da distrofina em células humanas em cultura. Além do sucesso no transporte, foi também possível verificar que as células afetadas foram capazes de produzir distrofina saudável. Através desta metodologia, será possível “curar” uma doença genética.
Numa outra experiência, os investigadores entregaram múltiplas moléculas ao mesmo tempo, com diferentes funções, numa tentativa de multi tasking.
O vírus de entrega modificado foi construído com base no bacteriófago T4, um fago que infeta um tipo específico de bactérias.
O fago T4 tem sido bastante estudado nas últimas décadas e é já bem compreendido pela comunidade científica. Este conhecimento aprofundado permite alterar e personalizar as suas características com alguma facilidade.
Neste estudo, os investigadores adicionaram um revestimento no vírus que permite que este seja engolido pelas células humanas, de forma a introduzir o seu conteúdo nas células.
Além disso, este vírus modificado é muito mais fácil e económico de produzir do que os vírus atualmente usados em terapia genética, afirma Rao, uma vez que não precisa de ser cultivado em células humanas.
No entanto, o grupo de Rao ainda não demonstrou o potencial deste vírus em seres humanos, diz Jeffrey Chamberlain, investigador da Universidade de Washington em Seattle, citado pela New Scientist.
A equipa de Chamberlain tem vindo a desenvolver terapias genéticas para a distrofia muscular de Duchenne, mas partindo de um princípio diferente, no qual o gene é dividido em vários fragmentos.
“No entanto, os primeiros dados são promissores e será interessante acompanhar os desenvolvimentos futuros”, acrescenta Chamberlain.
“Há uma grande necessidade de sistemas adicionais que forneçam terapias genéticas em várias células e órgãos do corpo”, afirma o investigador.
“É necessário muito trabalho para fazer o vírus funcionar no corpo humano”, diz Rao. Sem perder as expectativas, o investigador afirma que no imediato, o vírus modificado poderá ser usado para alterar células fora do corpo humano, com vista ao tratamento.
Um exemplo está em certos tipos de cancro, onde são utilizadas células imunológicas alteradas com o objetivo de eliminar tumores.
Geralmente este processo envolve várias etapas – primeiro utiliza-se um vírus para fornecer um gene de direcionamento e posteriormente fazem-se alterações adicionais, que incluem o fornecimento de componentes essenciais para a edição de genes, separadamente.
O grande obstáculo está em garantir que todas as células recebem todos os componentes. Os resultados têm demonstrado que nem todas as células têm as alterações desejadas, o que as torna menos eficazes quando injetadas numa pessoa com um tumor.
Com o vírus modificado é possível entregar todos os componentes necessários para a edição de genes de uma só vez, o que melhora substancialmente o processo.