Mariana Valério / ITQB
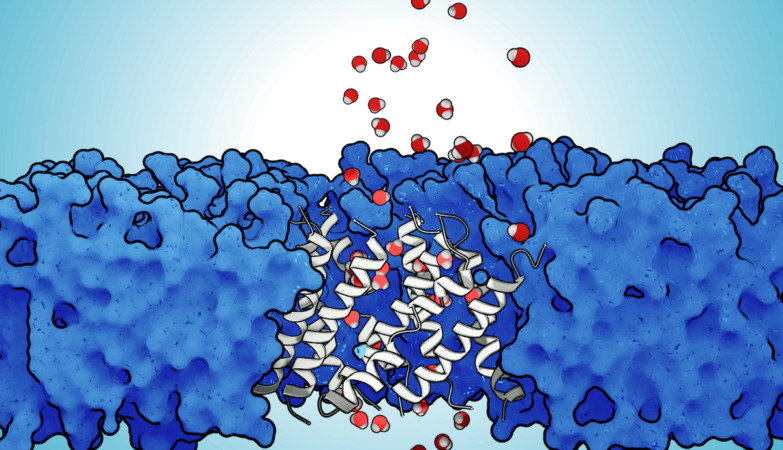
Ilustração sobre a formação da estrutura porosa.
Um equipa de investigadores portugueses descobriu o mecanismo que permite à bronquiolite e pneumonia infetar as células humanas.
Os portugueses descobriram o mecanismo que permite aos vírus parainfluenza infetar células humanas, criando uma estrutura até agora desconhecida, que permite a fusão do vírus com a membrana das nossas células.
Desde o o influenza (da gripe) ao SARS-CoV-2 (da covid-19), os grupos virais infiltram-se no corpo para se prenderem às células humanas — o envelope de um vírus e a membrana das nossas células fundem-se.
Nos vírus parainfluenza – responsáveis por bronquiolites ou pneumonias – sabe-se como se desencadeia esta fusão: uma região da proteína do vírus cria uma estrutura porosa, para fundir o envelope e a membrana.
Depois de o vírus entrar pelas vias respiratórias e se instalar nos pulmões, uma proteína do vírus (glicoproteína F) liga-se aos recetores da membrana das células.
Deste modo, a glicoproteína F sofre alterações, e permite a exposição de uma região da proteína chamada “péptido de fusão“.
Existem três péptidos em cada vírus, a tentar entrar em simultâneo na célula hospedeira. Encontram-se, assim, na membrana da célula do hospedeiro para cooperar e incitar a fusão entre o envelope do vírus e a membrana da célula.
“Quando [os péptidos] se encontram dentro da membrana do hospedeiro, formam uma estrutura porosa, com um túnel no centro, por onde podem passar moléculas de água. E isto vai ter impacto na membrana do hospedeiro e levar à fusão”, explica Diana Lousa, investigadora e uma das autoras do novo estudo, publicado na revista científica ACS Chemical Biology.
Os vírus parainfluenza são uma das principais causas de doenças respiratórias em crianças, mas também afetam adultos imunocomprometidos e idosos, com diagnósticos de bronquiolites ou pneumonias, segundo realça o Público.
“Não são vírus responsáveis por uma grande mortalidade, mas por muitas hospitalizações de crianças e também pessoas mais velhas, e têm um grande impacto a este nível”, sublinhou a investigadora.
Os investigadores ainda não tinham conseguido ver a cooperação entre os vários péptidos dos vírus no interior das células do hospedeiro, com microscópios normais.
O processo de formação da estrutura porosa acontece a um nível molecular e a solução encontrada pela equipa foi simular o mecanismo em computador.
“Já conhecíamos a estrutura do péptido na membrana [da célula do hospedeiro] e também já havia indicações de que estes péptidos se iriam juntar. E com base nestes pressupostos e em modelos que se podem aplicar a qualquer proteína e membrana, fizemos simulações. Deixámos que os péptidos espontaneamente criassem esta estrutura em forma de poro”, realça Diana Lousa.
Os investigadores também revelaram que só quando existe uma determinada quantidade de péptidos é que acontece uma infeção.
“Nestes modelos, vemos que só haveria infeção quando há uma determinada quantidade de péptidos. Aquilo que pensamos é que são necessários pelo menos seis péptidos para formar esta estrutura em poro, que depois contribui para a fusão”, acrescenta ainda a investigadora.
As simulações utilizadas pela equipa de investigadores portugueses têm um detalhe enorme, mas ainda não permitiram ver o processo completo – irá acontecer em “curto ou médio prazo”, diz a investigadora portuguesa.
“O que vimos aqui foi um primeiro passo nesse processo. A seguir, planeamos fazer novas simulações, com algumas simplificações, e ver todo o processo de fusão. Não só [ver] os péptidos, mas toda a proteína [glicoproteína F] dos vírus nas membranas das células humanas e acompanhar todo o processo de fusão”, admite.
Da equipa fizeram parte investigadores portugueses do Instituto de Tecnologia Química e Biológica António Xavier (ITQB), da Universidade Nova de Lisboa, e do Instituto de Medicina Molecular João Lobo Antunes (IMM).
// ZAP