ZAP // NightCafe Studio

Investigadores das Universidades da Pensilvânia e do Maine descobriram que, ao contrário do que é ditado pela Terceira Lei de Newton, nem toda a ação tem uma reação igual e oposta.
A Terceira Lei de Newton, conhecida como a Lei da Ação e Reação, está a passar por um momento difícil.
Em outubro, investigadores da Universidade de Kyoto, no Japão, apanharam espermatozoides a violar a conhecida lei, que diz que “cada ação tem uma reação igual e oposta”.
Num novo estudo, investigadores norte-americanos concluíram agora que também as interações moleculares que deram origem à vida contradizem o princípio estabelecido por Isaac Newton em 1687, na sua obra Philosophiæ Naturalis Principia Mathematica — ou simplesmente Principia, para os amigos.
A descoberta, que foi apresentada num artigo recentemente publicado na revista Chem, pode ajudar a compreender como certas interações moleculares evoluíram num mundo pré-vida.
A equipa, liderada por Ayusman Sen, professor de Química na Penn State, a Universidade Estadual da Pensilvânia, e Raymond Dean Astumian, físico teórico na Universidade do Maine, mostrou pela primeira vez o mecanismo por trás destas interações ao nível molecular.
“Todos já ouvimos a frase ‘toda a ação tem uma reação igual e oposta‘ para descrever a Terceira Lei de Newton, mas todos os dias vemos exemplos que parecem violá-la, especialmente no comportamento de sistemas vivos complexos, grandes e pequenos, onde haja um fluxo constante de energia”, explica Ayusman Sen em nota de imprensa publicada no site da Penn State.
“Um exemplo disso numa escala macroscópica é o caso de um predador, que é atraído pela sua presa — mas esta é repelida pelo predador”, exemplifica Sen.
No novo estudo, os investigadores estudaram dois tipos de enzimas, quinases e fosfatases, que catalisam reações bioquímicas. As quinases adicionam uma modificação química a outras moléculas, enquanto as fosfatases removem estas modificações.
Quando a fosfatase foi artificialmente imobilizada, a quinase foi atraída para ela. No entanto, quando a quinase foi imobilizada, a fosfatase foi repelida por ela, demonstrando que uma ação nem sempre tem uma reação igual e oposta.
Niladri Sekhar Mandal / Penn State
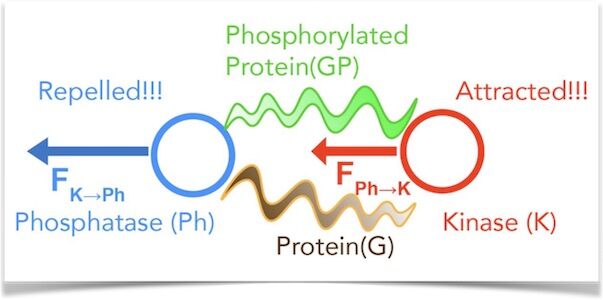
“A imobilização de uma das enzimas permite-nos ver como a outra se move em relação à primeira”, explica Niladri Sekhar Mandal, estudante de pós-graduação em engenharia química na Pen State e um dos autores do estudo.
“A não reciprocidade que observamos não se deve a nenhuma força externa, mas resulta de uma combinação de difusão e assimetrias cinéticas, que são propriedades das enzimas”, acrescenta o investigador.
A assimetria cinética determina o valor relativo das barreiras de energia que controlam a direção de uma reação em relação a um gradiente de concentração das enzimas, à medida que estas se movem num sistema molecular.
“As interações não recíprocas possibilitadas por esta assimetria cinética têm um papel crucial, ao permitir que as moléculas interajam entre si“, explica Sen.
“Isso pode ter desempenhado um papel crítico nos processos através dos quais a matéria simples se torna complexa, interagindo de formas que, em última análise, levaram à vida“, conclui o investigador da Penn State.















