Ashley Moon / Laboratório Süel, UC San Diego
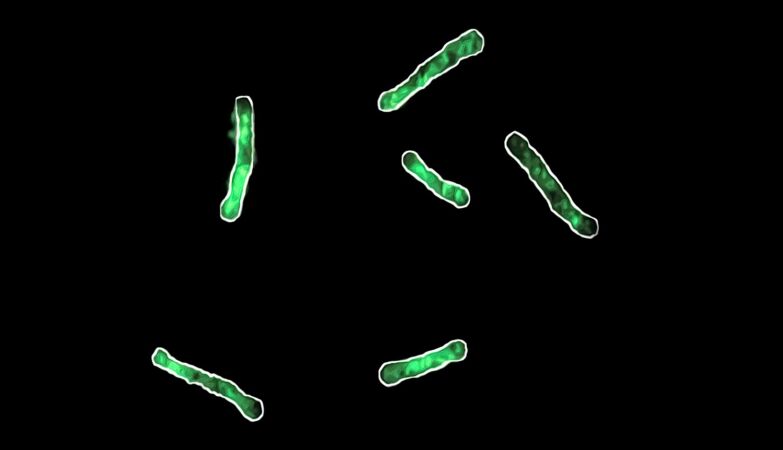
Bactéria Bacillus subtilis com fluorescência verde indicando falta de magnésio
Uma equipa de investigadores norte-americanos e espanhóis descobriu que uma estirpe de bactérias com uma mutação que lhe confere super-resistência aos antibióticos perde a sua capacidade de sobrevivência em situações em que os níveis de magnésio são baixos.
A resistência antimicrobiana representa um perigo significativo para a saúde humana. Segundo dados da OMS, as bactérias resistentes aos antibióticos poderão causar 2 milhões de mortes por ano até 2050.
Num novo estudo, investigadores norte-americanos e espanhóis descobriram agora que pelo menos algumas bactérias pagam um preço elevado pela sua resistência — um custo que talvez possamos explorar para combater as infeções causadas por bactérias super-resistentes.
“Descobrimos um calcanhar de Aquiles das bactérias resistentes aos antibióticos”, diz o biólogo molecular Gürol Süel, investigador da Universidade da Califórnia, em comunicado da UC.
“Podemos tirar partido deste custo para suprimir o estabelecimento da resistência aos antibióticos sem medicamentos ou produtos químicos nocivos”, acrescenta o investigador.
No decorrer do estudo, publicado em novembro na Science Advances, os investigadores exploraram a razão pela qual as bactérias com fatores de resistência não dominam necessariamente os seus parentes não resistentes.
A equipa descobriu então um caso de proteção que tem um custo para estas bactérias, impedindo a sua capacidade de sobrevivência em situações em que os níveis de magnésio são baixos.
“Embora pensemos frequentemente na resistência aos antibióticos como um benefício importante para a sobrevivência das bactérias, descobrimos que a capacidade de lidar com a limitação de magnésio no seu ambiente é mais importante para a proliferação bacteriana”, explica Süel .
A privação de magnésio pode contrariar a capacidade das bactérias de se desenvolverem. E como as estirpes não mutadas não partilham a mesma falha, a redução do nutriente chave não deve ter um impacto negativo nas bactérias necessárias para um microbioma saudável.
Os metais carregados, como os iões de magnésio, estabilizam os ribossomas — as micro máquinas das células que criam as proteínas. Os iões também têm um papel importante na utilização do ATP que alimenta as nossas células.
Uma versão mutante do ribossoma L22 em alguns Bacillus subtilis protege a estirpe contra os antibióticos e liga-se fortemente ao átomo de magnésio carregado, deixando menos ATP para a produção de energia celular, explica o Science Alert.
A modelação utilizada pela equipa de investigadores revelou que este custo fisiológico impede a capacidade de crescimento e propagação da estirpe mutada, em comparação com a B. subtilis não mutada.
“A competição intracelular por uma reserva finita de magnésio pode assim suprimir o estabelecimento de uma variante de ribossoma resistente a antibióticos”, escrevem os investigadores no seu artigo.
Isto significa que, sem a pressão dos antibióticos, o B. subtilis não mutado é mais apto do que o B. subtilis resistente aos antibióticos.
“Mostramos que, através de uma melhor compreensão das propriedades moleculares e fisiológicas das bactérias resistentes aos antibióticos, podemos encontrar novas formas de as controlar sem a utilização de medicamentos“, explica Süel.
“Esperamos que o nosso trabalho possa ajudar a identificar as condições que impedem as estirpes resistentes aos antibióticos sem exigir o desenvolvimento de novos antibióticos”, concluem Moon e a sua equipa.














