Guardant Health

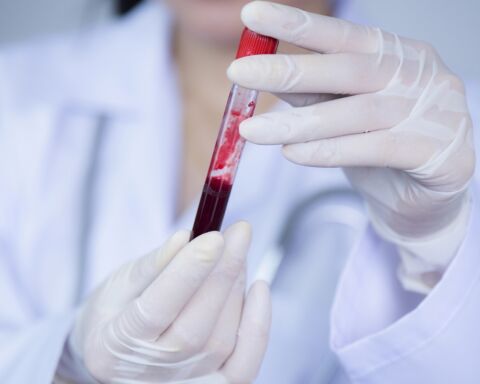
A Food and Drug Administration, agência norte-americana do medicamento, anunciou esta segunda-feira a aprovação do método de análise ao sangue da Guardant Health para despistar o cancro do colorretal.
A amostra de sangue necessária para o novo teste, denominado Shield, pode ser obtida numa consulta médica ou através de um laboratório comercial e deve ser feito de três em três anos, enquanto as colonoscopias são recomendadas a cada dez anos.
Segundo o Live Science, o teste foi aprovado para adultos a partir dos 45 anos que tenham risco médio de contrair a doença.
No ensaio clínico em humanos, cujos resultados foram apresentados em março num artigo publicado no The New England Journal of Medicine, o teste mostrou sensibilidade de 83% ao cancro, o que significa que o identificou corretamente em grande parte das vezes.
O ensaio clínico revelou que o Shield não é tão eficaz na deteção de pólipos pré-cancerosos avançados, que detetou em apenas 13% dos casos, pelo que não pode ser utilizado em substituição de terapias mais invasivas.
Em 10% dos casos, pessoas sem cancro colorrectal registaram um falso positivo, pelo que um resultado positivo para cancro no teste Shield obriga à realização de colonoscopia de seguimento para confirmar o diagnóstico e localizar os tumores.
“O padrão para o rastreio do cancro do cólon é a colonoscopia, porque consegue detetar o cancro do cólon nas suas fases mais precoces e tratáveis e pode encontrar e remover pólipos pré-cancerosos antes de estes terem a oportunidade de se transformarem em cancro”, salientou o gastroenterologista, Jon LaPook.
O teste, que tem uma taxa de precisão para a deteção do cancro do cólon semelhante à dos testes de fezes utilizados para a deteção precoce do cancro, pode constituir uma alternativa para os doentes que, de outra forma, poderiam recusar as opções de rastreio atuais.
“A aprovação do Shield pela FDA é uma vitória significativa para os doentes. O teste pode ajudar a melhorar as taxas de rastreio do cancro colorrectal, para que possamos detetar mais cancros numa fase inicial, quando são tratáveis”, explica o co-CEO da Guardant Health, AmirAli Talasaz, em comunicado.
A aprovação do teste sanguíneo Shield pela FDA oferece assim uma nova solução para colmatar a falta de aderência das pessoas e ainda uma ajuda a tornar os testes de rastreio mais acessíveis.