Alyssa Stone / Northeastern University
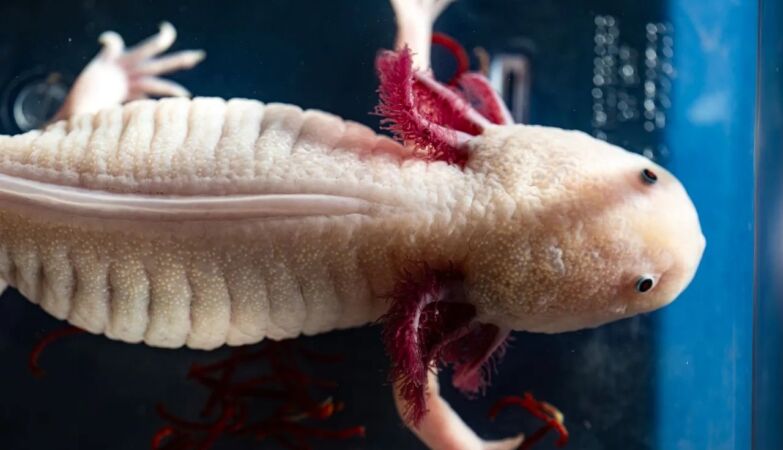
Exemplar de axolote mexicano (Ambystoma mexicanum)
Investigadores da Universidade de Northeastern identificaram o mecanismo-chave por trás da notável capacidade do axolote de regenerar membros inteiros. Esta espécie de salamandra usa um “GPS molecular”, e tem um gene regulador que “fala” com as células danificadas.
Um novo estudo, publicado na Nature Communications, revela que o segredo da regeneração de membros dos axolotes não está em produzir mais de uma molécula crítica, mas em controlar a sua destruição.
O axolote mexicano (Ambystoma mexicanum), uma espécie de salamandra que não se desenvolve na fase de larva, há muito tempo que fascina os cientistas com a sua capacidade de regenerar membros, partes do coração, e até a medula espinal.
No novo estudo, um equipa de investigadores da Universidade de Northeastern, liderada pelo biólogo James Monaghan, resolveu uma das questões mais intrigantes da biologia regenerativa: como é que um membro amputado consegue “saber” exatamente quais as partes que precisam de ser regeneradas?
“Durante anos, sabíamos que o ácido retinóico, um derivado da vitamina A, é uma molécula crucial que dá sinal às células para ‘construir um ombro'”, explica Monaghan, citado pela revista Wired.
“Mas não compreendíamos como as células no coto do membro em regeneração controlavam os seus níveis com tanta precisão para saber exatamente onde estavam no eixo do ombro à mão”, detalha o investigador.
A surpreendente descoberta da equipa revela que a identidade posicional das células depende de um gradiente preciso de ácido retinóico ao longo do membro. Este gradiente não é criado pela produção de diferentes quantidades de ácido retinóico, mas por taxas variáveis da sua destruição.
As células na área do pulso contêm níveis elevados de uma enzima chamada CYP26B1, que destrói o ácido retinóico. Em contraste, as células do ombro têm quantidades mínimas desta enzima, permitindo que o ácido retinóico se acumule.
Isto cria um gradiente químico que serve como um GPS molecular, informando as células da sua posição exata ao longo do membro.
Alyssa Stone / Northeastern University

Axolotes no laboratório do professor James Monaghan
Para testar a sua teoria, os investigadores realizaram uma experiência engenhosa: amputaram patas de axolotes no pulso e administraram talarozole, um medicamento que inibe a enzima CYP26B1.
Ao impedir a destruição do ácido retinóico, o químico acumulou-se em níveis elevados na área do pulso, confundindo as células, e fazendo-as “pensar” que estavam no ombro. Em vez de regenerarem apenas uma mão, as células produziram um membro duplicado inteiro.
A equipa identificou também um gene regulador, designado Shox, ativado por níveis elevados de ácido retinóico.
Usando a tecnologia de edição genética CRISPR, os autores do estudo eliminaram este gene em embriões de axolote, o que resultou em animais com mãos e dedos normais, mas com braços e antebraços muito subdesenvolvidos.
Este resultado confirmou que o Shox regula especificamente o desenvolvimento de estruturas como o braço superior e o antebraço.
“Identificámos o Shox como um manual de instruções crítico neste processo“, explica Monaghan. “É o gene que diz às células em desenvolvimento para ‘construir os ossos do braço e do antebraço’.”
Segundo os investigadores, o que torna esta descoberta particularmente intrigante é que os humanos têm os mesmos genes fundamentais que os axolotes. A diferença não está em ter “genes de regeneração” únicos, mas na forma como estes genes são acedidos após uma lesão.
Enquanto as células humanas respondem a lesões formando tecido cicatricial, as células do axolote reverteram a sua diferenciação para um estado semelhante ao embrionário, permitindo-lhes responder a sinais de desenvolvimento como o ácido retinóico.
“A diferença está na acessibilidade desses genes“, observa Monaghan. “Enquanto uma lesão nos humanos ativa genes que induzem a cicatrização, nas salamandras há desdiferenciação celular: as células retornam a um estado semelhante ao embrionário onde podem responder a sinais como o ácido retinóico.”
O ‘santo graal’ da biologia regenerativa é conseguir induzir a formação de células embrionárias ainda indiferenciadas em locais de amputação em humanos, explica Monaghan.
“Compreender os componentes mínimos deste processo — os sinais moleculares, o ambiente celular e as condições fisiológicas em que ocorre — poderia permitir-nos transformar uma cicatriz em tecido regenerativo“, conclui o investigador.