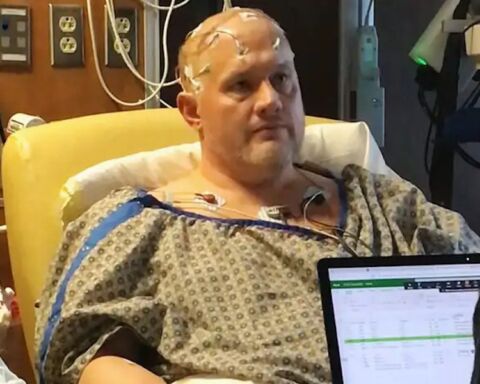
Banhista a flutuar na água extremamente salgada do Mar Morto, na costa de Israel
Se os oceanos são alimentados principalmente por rios de água doce, porque é que a sua água é salgada? Não, não é por terem demasiado bacalhau de molho…
À primeira vista, pode parecer estranho que o mar seja salgado, especialmente se tivermos em conta que a água que corre para o oceano provém de rios e ribeiros, que são de água doce.
Então, porque motivo o mar dos oceanos é salgado?
A resposta a esta pergunta leva-nos a explorar os complexos processos naturais que moldaram o nosso planeta ao longo de milhões de anos, explica-nos o professor Antonio Figueras Huerta, investigador do Instituto de Investigaciones Marinas, em Espanha, num artigo no The Conversation.
A água doce que chega ao oceano não está completamente isenta de sais e minerais. Estes são dissolvidos nas rochas terrestres, um processo que começa com a chuva, que contém pequenas quantidades de dióxido de carbono do ar, o que a torna um ácido fraco.
Quando esta chuva cai sobre as rochas, o ácido dissolve pequenas partículas de minerais e sais. Estas são transportadas pelos rios e ribeiros, acabando por chegar ao oceano.
No entanto, não sentimos o sabor do sal nos rios, ribeiros e lagos. Isto deve-se ao facto de a água doce, constantemente renovada pela chuva, diluir as quantidades de sais dissolvidos. O volume de água doce é muito maior do que o volume de minerais dissolvidos.
Quando a água doce dos rios corre para o oceano, transporta consigo estes minerais. Mas o oceano, ao contrário dos lagos e rios, é um sistema cumulativo. O sal e os minerais não são facilmente removidos, acumulando-se ao longo do tempo.
Para além disso, há outro processo fundamental que acrescenta minerais aos oceanos: as fontes hidrotermais no fundo do mar.
No fundo do mar, a água infiltra-se através de fissuras na crosta terrestre, onde é aquecida pelo magma subterrâneo. A água quente (até 400°C) atua sobre as rochas, dissolvendo sais e minerais de forma semelhante ao açúcar num copo de leite quente.
Esta mistura enriquecida com minerais é libertada de volta para o oceano através de respiradouros, acrescentando ainda mais componentes dissolvidos à água do mar.
Os vulcões submarinos também têm um papel importante na salinidade dos oceanos. Durante as erupções, libertam uma mistura de minerais dissolvidos e gases que enriquecem a água do mar com uma variedade de iões.
Uma molécula perfeita
O ião sódio (Na) e o ião cloreto (Cl) são os dois iões mais abundantes na água do mar: juntos representam cerca de 85% de todos os sais dissolvidos no oceano. A sua combinação forma o cloreto de sódio (NaCl), ou sal comum.
Para além de serem os principais responsáveis pela salinidade do oceano, estes iões ajudam a regular propriedades essenciais do mar, como a densidade e a condutividade.
Uma caraterística interessante é que a relação entre o sódio e o cloreto na água do mar permanece praticamente constante numa proporção de 1:1, o que o torna único em comparação com outros iões.
Em média, o mar contém cerca de 3,5 % de sal, o que significa que cada litro de água do mar contém cerca de 35 gramas de sal. Existe também algum ouro, mas em quantidades tão reduzidas que a sua exploração não é rentável.
Por outro lado, a salinidade do mar não é uniforme em todo o globo. Tende a ser mais baixa perto do equador e nos polos, onde há mais precipitação e derretimento de gelo, respetivamente, o que dilui o sal.
Entretanto, nas zonas de latitude média, onde a evaporação é maior, a salinidade tende a aumentar.
Um exemplo extremo é o Mar Mediterrâneo, que é mais salgado do que o Oceano Atlântico devido à forte evaporação e ao reduzido aporte de água doce.
Os lagos salgados, como o Mono na Califórnia ou o Mar Cáspio na Ásia, têm uma salinidade ainda mais elevada do que o oceano. Localizam-se em regiões áridas onde a entrada de água doce é limitada e a evaporação é elevada. Como resultado, os sais tornam-se cada vez mais concentrados.
Um exemplo extraordinário é o Mar Morto, situado entre a Jordânia e Israel. Trata-se de um lago salgado com um dos níveis de salinidade mais elevados do mundo: cerca de 340 gramas de sal por litro, quase dez vezes mais do que o oceano.
Nestes locais, a acumulação de sal é um processo constante e, com o tempo, o nível de sal continua a aumentar.
Oceanos antigos, não tão salgados
Nos oceanos primitivos, a salinidade era provavelmente muito mais baixa. Há biliões de anos, quando a Terra estava coberta por oceanos grandes e jovens, a chuva começou a cair e a corroer as rochas dos continentes recém-formados. Estes minerais foram transportados para o mar, dando início ao processo de acumulação.
Atualmente, os cientistas estimam que os rios e ribeiros de todo o mundo transportam anualmente para o oceano cerca de quatro mil milhões de toneladas de sais dissolvidos.
Apesar desta enorme quantidade, o nível de salinidade dos oceanos manteve-se relativamente constante nos últimos 200 milhões de anos. Como é que isto é possível?
O oceano atingiu um equilíbrio dinâmico. A quantidade de sal que entra é igual à quantidade que é retirada.
Alguns dos sais dissolvidos precipitam-se e depositam-se como sedimentos no fundo do mar, formando novos minerais. Este processo, juntamente com a absorção de minerais pelos organismos marinhos, ajuda a manter o nível de salinidade estável.
Por outras palavras, embora os rios e as fontes hidrotermais continuem a adicionar sais ao oceano, uma quantidade semelhante destes sais é removida através da precipitação e de outros processos naturais.
Da próxima vez que mergulhar no oceano e sentir o sabor salgado nos seus lábios, lembre-se que está a experimentar o resultado de milhares de milhões de anos de processos geológicos e químicos.
A salinidade do mar é uma prova tangível da interação contínua entre a atmosfera, a terra e o oceano, um equilíbrio que tem sido essencial para a vida tal como a conhecemos.