IRRI Images / Flickr
A descoberta resolve um mistério de décadas e abre novos caminhos de pesquisa em milhares de moléculas semelhantes, muitas dos quais susceptíveis de ser clinicamente úteis.
Investigadores da Universidade do Illinois, nos EUA, anunciaram num estudo publicado na revista Nature um grande avanço na compreensão de como um poderoso antibiótico é produzido na natureza.
Os cientistas concentraram-se numa classe de compostos com propriedades antibióticas, o mais conhecido dos quais é a nisina, um produto natural do leite que pode ser sintetizado em laboratório e é adicionado aos alimentos como conservante.
A nisina tem sido usada para combater patógenos de origem alimentar desde o final dos anos 1960.
Os investigadores já conheciam a sequência do gene da nisina, e conseguem reproduzir a cadeia de aminoácidos (peptídeo) que são codificados por esse gene.
Mas o peptídeo sofre várias modificações na célula depois de ter sido produzido, mudanças que lhe dão a sua forma final e função. Os investigadores têm tentado ao longo de mais de 25 anos entender como essas mudanças ocorrem.
L. Brian Stauffer / illinois.edu/

A equipa da Universidade do Illinois que resolveu um mistério de décadas sobre como uma classe de antibióticos é produzida: Manuel A. Ortega, Wilfred van der Donk, Yue Hao, Satish Nair e Mark Walker.
“Os peptídeos são um pouco como o esparguete, são demasiado flexíveis para fazer o seu trabalho”, diz Wilfred van der Donk, professor de química e investigador da Universidade de Illinois, que liderou a pesquisa em conjunto com o bioquímico Satish Nair. “A natureza começa a fazer o cíclico peptídico”.
Enzimas especiais fazem este trabalho. No caso da nisina, uma enzima chamada uma desidratase remove a água para ajudar a dar ao antibiótico a sua forma tridimensional final. Este é o primeiro passo para converter o péptideo semelhante a esparguete numa estrutura de cinco anéis, explica van der Donk.
Os anéis são essenciais para a função de antibiótico de nisina: dois deles interrompem a construção de paredes de células bacterianas, ao passo que os outros três fazem furos nas membranas bacterianas.
Esta dupla acção é especialmente eficaz, tornando-se muito mais difícil aos micróbios desenvolverem resistência ao antibiótico.
Estudos anteriores mostraram que a desidratase foi envolvida nestas modificações mas os investigadores não foram capazes de determinar como aconteceu.
Isto tem impedido a descoberta, produção e estudo de dezenas de compostos similares que também podem ser úteis no combate a doenças de origem alimentar ou infecções microbianas perigosas, diz o cientista.
Através de um minucioso processo de eliminação, Manuel Ortega, um estudante de pós-graduação no laboratório van der Donk, estabeleceu que o aminoácido glutamato foi essencial para a transformação da nisina.
“Descobriu-se que a desidratase fez duas coisas: adicionou glutamato ao peptídeo da nisina, e eliminou glutamato. Mas como pode uma enzima ter duas actividades diferentes?”, interroga-se o bioquímico Satish Nair.
Ayacop / Wikimedia
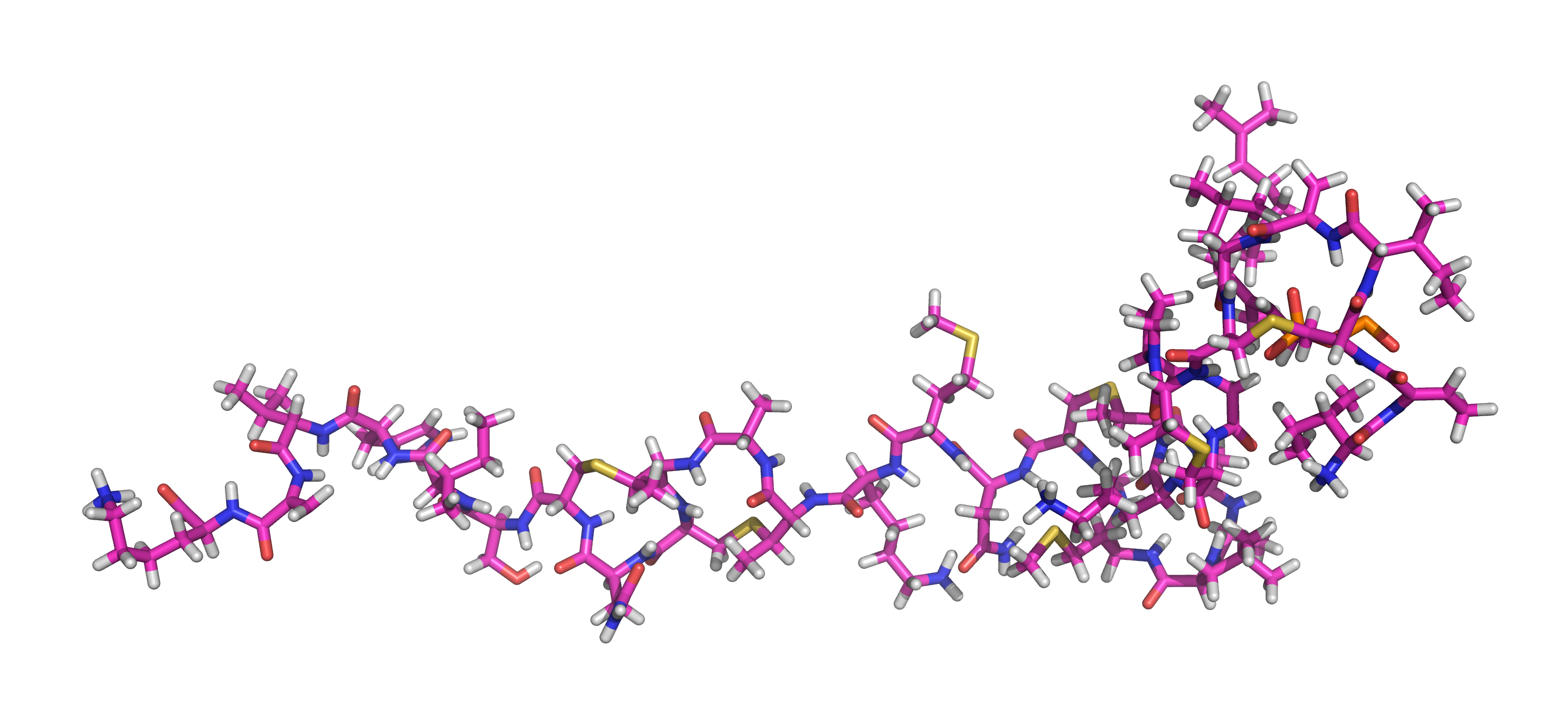
Modelo 3D da molécula de Nisina
Para ajudar a responder a esta pergunta, Yue Hao, uma estudante de pós-graduação no laboratório de Nair, utilizou cristalografia de raios-X para visualizar como a desidratase se liga ao peptídeo da nisina.
Hao descobriu que a enzima interage com o péptideo de duas maneiras: agarra rapidamente uma parte e segura-a, enquanto uma parte diferente ajuda a instalar as estruturas de anel.
“Há uma parte do precursor peptídeo que é mantido constante, e há uma parte que é flexível. E a parte flexível é realmente onde a química é realizada”, explica Nair.
“Neste estudo, resolvemos um monte de interrgações que os cientistas têm tido sobre como a desidratação funciona a um nível químico”, diz van der Donk.
“E verifica-se que na natureza um número bastante grande de produtos naturais – muitos deles com potencial terapêutico – são feitos de forma semelhante.”
“Isto é realmente como acender uma luz onde antes era escuro. Agora nós e outros laboratórios podemos fazer todos os tipos de coisas que não podíamos fazer antes”, conclui van der Donk.










